Struktur Atom, Percobaan tabung vakum, Teori atom Rutherford, Spektrum atom
STRUKTUR ATOM
STRUKTUR ATOM
Dalton dan ilmuwan sebelum abad ke-19 mempercayai bahwa atom adalah komponen terkecil materi dan tak dapat terbagi lagi.
Berbagai penelitian dilakukan oleh para ahli untuk mengetahui apakah ada bagaian yang terkecil dari atom. Diantara mereka adalah: Faraday, Robert Andrew Milikan (1868-1953) dan Joseph John Thomson (1856-1940).
Percobaan tabung vakum:
Saat kation dan anoda saling bersinggungan dan diberi beda potensial yang tinggi pada tekanan yang rendah, gas dalam tabung walaupun merupakan insulator, menjadi penghantar dan memancarkan cahaya. Bila tabung mulai divakumkan maka dindingnya akan mulai mengkilap dan memancarkan cahaya (fluoresensi). Fisikawan Jerman Julius Plucker (1801-1868) menginterprestasikan bahwa sinar ini adalah partikel yang dipancarkan dari katoda (sinar katoda).
Partikel yang belum teridentifikasi ini saat dipancarkan dari katoda akan menuju dinding tabung atau anoda. Jika diberikan medan listrik lintasannya akan berubah/dibelokkan yang mengindikasikan bahwa sinar tersebut bermuatan. Sifat cahaya tidak bergantung pada jenis gas dalam tabung dan jenis logam pada katoda.
Fisikawan Inggris Joseph John Thomson (1856-1940) menunjukkan bahwa cahaya tersebut bermuatan partikel negative. Ia juga mendapatkan rasio massa dan muatannya.
Joseph John Thomson (1856-1940)
Fisikawan Amerika Robert Andrew Milikan (1868-1953) melalui percobaannya, percobaan tetes minyak Milikan, membuktikan bahwa partikel kelistrikan ini bermuatan electron sebesar 1,6 x 10 pangkat -19 C.
Perhitungan massa electron. Hitung massa electron dengan menggunakan nilai yang didapat Milikan dan Thomson.
Model Atom
Ukuran atom
Setelah mengetahui bahwa atom memiliki bagian terkecil (dapat dibagi) maka ilmuwan mulai tertarik untuk mengetahui seberapa besar ukuran atom. Suatu pendekatan untuk mengetahui volume atom adalah: membagi volume 1 mol padatan dengan konstanta Avogadro.
Contoh:
Dengan menganggap molekul air berbentuk kubus, hitung panjang sisi kubus. Dengan menggunakan nilai yang didapat, perkirakan ukuran kira-kira 1 atom.
Penemuan inti atom
Setelah para ilmuwan mengetahui bahwa atom memiliki muatan (positif dan negative) dan dapat memancarkan radiasi radioaktif, mereka tertarik untuk mengetahui bentuk struktur atom.
Rutherford melakukan penelitian dengan menembakkan berkas partikel α (inti atom He) ke lempeng logam tipis. Dari hasil penelitiannya dia merumuskan:
Teori atom Rutherford:
Muatan poitif atom berpusat di tengah (inti) dengan massa yang cukup besar tapi diameternya sangat kecil (kira-kira 10-12 cm). Muatan n egative atom terdispersi di seluruh ruang atom.
Skema percobaan Rutherford
Kelemahannya:
- Jika electron tidak bergerak, electron akan bersatu dengan inti karena tarikan electrostatic (gaya Coulomb). Hal ini tidak mungkin terjadi karena atom adalah kesatuan yang stabil.
- Bila electron mengelilingi inti seperti planet dalam pengaruh gravitasi matahari, electron akan mengalami percepatan dan akan kehilangan energy melalui radiasi elektrostatik. Akibatnya, orbitnya akan semakin dekat ke inti dan akhirnya electron akan jatuh ke inti. Dengan demikian, atom akan memmancarkan spectrum yang kontinyu. Kenyataannya, atom yang stabil memancarkan spectrum garis.
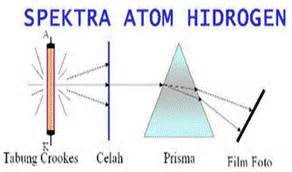
Spektrum atom
Apabila sebuah logam atau senyawanya dipanaskan maka warna khas logam akan muncul. Apabila warna khas ini dipisahkan dengan prisma maka akan terlihat garis spectra dengan panjang gelombang yang berbeda.
Untuk memahami spectrum atom; dimisalkan ada gas dalam tabung vakum yang diberi beda potensial tinggi. Sesaat kemudian gas akan terlucuti dan akan memancarkan cahaya. Dengan sebuah prisma cahaya yang dihasilkan dapat menghasilkan garis-garis spectra diskontinyu. Panjang gelombang yang dihasilkan untuk setiap cahaya berbeda-beda. Spectrum yang dihasilkan disebut dengan spectrum atom.
Fisikawan Swedia Johannes Robert Rydberg menemukan bahwa bilangan gelombang σ (jumlah gelombang dalam satu satuan panjang, misalnya per 1 cm) garis spectra dapat diperoleh dengan persamaan: